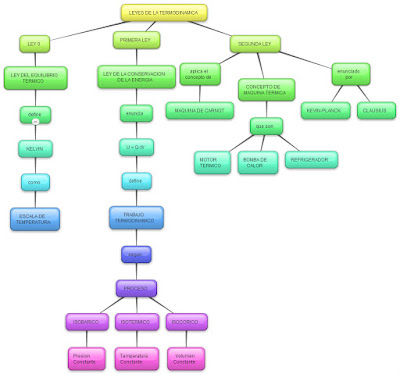
PRINCIPIO
CERO DE LA TERMODINÁMICA
Este
principio o ley cero, establece que existe una determinada propiedad denominada
temperatura empírica θ, que es común para todos los estados de equilibrio
termodinámico que se encuentren en equilibrio mutuo con uno dado.
En
palabras simples: «Si se pone un objeto con cierta temperatura en contacto con
otro a una temperatura distinta, ambos intercambian calor hasta que sus
temperaturas se igualan».
Este
principio fundamental, aún siendo ampliamente aceptado, no fue formulado
formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que
recibiese el nombre de principio cero.
Entonces:
Si dos sistemas están por separado en equilibrio con un tercero, entonces
también deben estar en equilibrio entre ellos.
Si
tres o más sistemas están en contacto térmico y todos juntos en equilibrio,
entonces cualquier par está en equilibrio por separado.
PRIMER
PRINCIPIO DE LA TERMODINÁMICA
También
conocida como principio de conservación de la energía para la termodinámica,
establece que si se realiza trabajo sobre un sistema o bien este intercambia
calor con otro, la energía interna del sistema cambiará.
Visto de otra forma, esta ley permite definir el
calor como la energía necesaria que debe intercambiar el sistema para compensar
las diferencias entre trabajo y energía interna.
Fue propuesta por Nicolas
Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz
del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la
que expuso los dos primeros principios de la termodinámica.
NICOLAS LÉONARD SADI CARNOT
La
ecuación aplicada a la termodinámica teniendo en cuenta
el criterio de signos termodinámico es:
Dónde:
- U es la energía interna del sistema (aislado).
- Q es la cantidad de calor
aportado al sistema.
- W es el trabajo realizado por el sistema.
Esta última expresión es igual de frecuente
encontrarla en la forma:
Ambas
expresiones, aparentemente contradictorias, son correctas y su diferencia está
en que se aplique el convenio de signos IUPAC o el Tradicional (revise el criterio
de signos termodinámico).
SEGUNDO
PRINCIPIO DE LA TERMODINÁMICA
En
un estado de equilibrio, los valores que toman los parámetros característicos
de un sistema termodinámico cerrado son tales que maximizan el valor de una
cierta magnitud que está en función de dichos parámetros, llamada entropía.
El
segundo principio de la termodinámica establece que dicha entropía sólo puede
definirse para estados de equilibrio termodinámico, y que de entre todos los
estados de equilibrio posibles –que vendrán definido por los parámetros
característicos–, sólo se puede dar el que, de entre todos ellos, maximiza la
entropía.
Visualmente,
el segundo principio se puede expresar imaginando una caldera de un barco de
vapor. Ésta no podría producir trabajo si no fuese porque el vapor se encuentra
a temperaturas y presión elevadas comparados con el medio que la rodea.
ILUSTRACIÓN DE LA SEGUNDA LEY MEDIANTE UNA MÁQUINA TÉRMICA
Matemáticamente,
se expresa así:
Dónde:
- S es la entropía del sistema termodinámico.
- El símbolo de igualdad sólo existe cuando la entropía se
encuentra en su valor máximo (en equilibrio).
Existen
numerosos enunciados equivalentes para definir este principio, destacándose el
de Clausius y el de Kelvin.
- Enunciado de Clausius: Diagrama
del ciclo de Carnot en función de la presión y el volumen.«No es posible ningún proceso cuyo único resultado sea la
extracción de calor de un recipiente a una cierta temperatura y la absorción de
una cantidad igual de calor por un recipiente a temperatura más elevada».
-
Enunciado de Kelvin-Planck:"Es imposible construir una máquina que,
operando cíclicamente, produzca como único efecto la extracción de calor de un
foco y la realización equivalente de trabajo".
TERCER PRINCIPIO DE LA TERMODINÁMICA
El
postulado de Nernst, llamado así por ser propuesto por Walther Nernst, afirma
que es imposible alcanzar una temperatura igual al cero absoluto mediante un
número finito de procesos físicos.
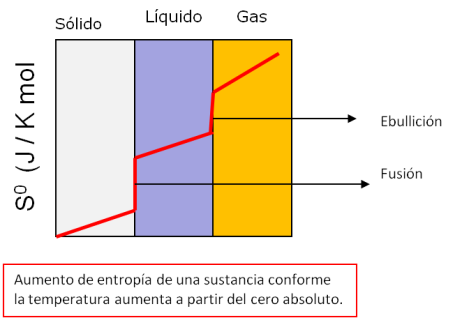
Puede formularse también como que a medida
que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor
constante específico. La entropía de los sólidos cristalinos puros puede
considerarse cero bajo temperaturas iguales al cero absoluto.
- Al
llegar al cero absoluto, 0 K, cualquier proceso de un sistema físico se
detiene.
-
Al
llegar al cero absoluto la entropía alcanza un valor mínimo y constante.
Con
el desarrollo de la mecánica estadística, la tercera ley de la termodinámica
(como las otras leyes) pasó de ser una ley fundamental (justificada por
experimentos) a una ley derivada (derivada de leyes aún más básicas). La ley
básica de la que deriva principalmente es la definición estadístico-mecánica de
la entropía de un sistema grande:
Dónde:
- S
es la entropía del sistema termodinámico.
- kB
es la constante de Boltzmann.
- Ω es
el número de microestados consistentes con la configuración macroscópica.
SISTEMA
TERMODINÁMICO
Conjunto de materia, que está limitado por
unas paredes, reales o imaginarias, impuestas por el observador.
En la naturaleza, encontrar un sistema estrictamente aislado es, por lo
que sabemos, imposible, pero podemos hacer aproximaciones. Un sistema del que
sale y/o entra materia, recibe el nombre de abierto. Ponemos unos ejemplos: