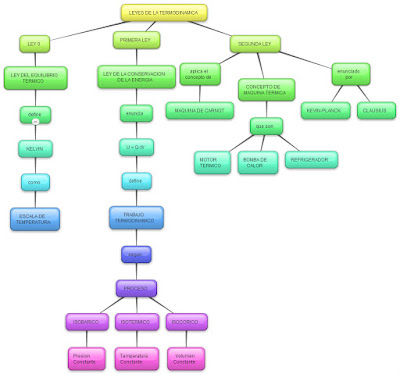
LEYES DE LA TERMODINÁMICA EN PROCESO METABÓLICOS
La
Termodinámica estadística ofrece una descripción de las propiedades macroscópicas
usando los micro parámetros de un sistema.
Un
área importante de aplicación de la termodinámica es en las reacciones
moleculares que ocurren en el ADN para su separación de las dos
hebras para que se lleve a cabo la transcripción.
Los sistemas biológicos están constituidos
básicamente de 4 elementos químicos, hidrógeno (63 %), oxígeno (25.5 %),carbono
(9.5 %), y
Nitrógeno
(1.4 %). El restante 0.6 % de los átomos que los conforman Provienen de otros
20 elementos químicos esenciales para la vida (hierro, Calcio, fósforo, zinc,
potasio, etc.). La abundancia de átomos de hidrógeno y oxígeno en un sistema
biológico se ilustra recordando que el 72 % de la masa total del cuerpo humano
es agua.
REACCIONES METABÓLICAS:
Los nutrientes que consumimos son procesados para formar parte de
nuestras células, ADN, proteínas, etc.
Si las reacciones bioquímicas
involucradas en este proceso fueran reversibles, si dejamos de comer aunque sea
por un período de tiempo relativamente corto, podríamos convertir nuestro ADN
nuevamente en las moléculas de comida. Para evitar que esto ocurra nuestro
metabolismo está organizado en vías metabólicas.
Estas vías son una serie de
reacciones bioquímicas que en su conjunto son irreversibles.
Las reacciones de
una vía metabólica ocurren en orden donde los productos de la primera reacción
son los reactivos de la siguiente reacción en la vía y así sucesivamente:
A ⇌ B ⇌ C ⇌ D ⇌ E
Al menos una de estas
reacciones tiene que ser irreversible, ósea:
A ⇀ B ⇌ C ⇌ D ⇀ E
El control del paso irreversible (es decir A → B) le permite a la célula
controlar la vía metabólica entera y, de esta
manera, la cantidad de reactivos consumidos y productos formados.
VÍA METABÓLICA EN EL CUERPO HUMANO.
TERMOREGULACIÓN
Es
la capacidad que tiene un organismo biológico para modificar su temperatura
dentro de ciertos límites, incluso cuando la temperatura circundante es muy
diferente
Temperatura
promedio en humanos: 36.7 ºC
Ejemplo:
El hipotálamo compara la temperatura en el mismo y en la piel con el valor de
referencia de 37º C, si la Tº corporal es mayor de 37ºC pone en marcha
mecanismos para que disminuya, si es menor, pone en acción mecanismos para que
ésta aumente.
El
hipotálamo actúa sobre la temperatura corporal mediante mecanismos múltiples
como: sudoración, circulación cutánea, contracción muscular, piloerección, aumento
del metabolismo, etc.